基因剂量的变化在胚胎发育、疾病发生以及细胞命运决定过程中发挥着关键作用,其系统化解析对于精准理解生命过程至关重要。作为研究基因功能的核心策略,基因扰动近年来与单细胞组学的结合,使研究者能够在全基因组尺度上系统解析基因的功能,并为虚拟细胞等人工智能模型的构建提供了宝贵的数据支撑。然而,现有的大规模基因扰动技术大多将基因功能简化为“开/关”的二元模式,难以捕捉剂量依赖的连续效应。这种局限不仅削弱了对基因功能的全面理解,也可能在复杂生物学问题中引入不全面甚至错误的结论。
2025年10月3日,中国科学院深圳先进技术研究院合成生物学研究所陈万泽课题组与瑞士洛桑联邦理工学院(EPFL)Bart Deplancke课题组合作,在Nature Genetics发表了题为"Dissecting the impact of transcription factor dose on cell reprogramming heterogeneity using scTF-seq"的研究成果。团队开发了scTF-seq技术,实现了剂量敏感的大规模基因扰动单细胞组学,并以转录因子介导的细胞重编程为模型,系统揭示了基因剂量在细胞命运调控中未被充分认识的多层次、非线性复杂效应。
为什么scTF-seq可以实现大剂量范围的基因扰动并定量?
巧妙利用Tet-on启动子内在噪音和逆转录病毒基因组不同整合位置表达活性差异,进一步结合高滴度病毒转导的拷贝数差异(有别于传统大规模扰动中常用的低滴度方式)。这种设计使得即使单一Doxycycline浓度下,转基因的剂量也可以达到平均60倍,最高1000倍的极宽剂量分布。并结合3’scRNA-seq兼容的条形码,定量解析转录因子剂量与转录组变化之间的对应关系,从而首次在大规模基因扰动背景下实现了“剂量敏感”的功能解析。
单基因的复杂非线性效应
scTF-seq揭示了转录因子剂量并非简单线性地影响细胞命运。例如,KLF4在不同剂量下分别驱动与骨骼形成、细胞结构组装或上皮发育相关的不同基因表达模式,表现出高度非线性的调控特征。这些复杂剂量效应为解释细胞重编程的异质性提供了重要线索。
基因与其他细胞过程的互作
研究还发现,基因剂量效应与细胞周期等其他细胞过程密切相关。CEBPA和PPARG在高剂量下促进细胞周期退出并推动脂肪分化,而MYCN则突破常规,在细胞持续增殖的同时驱动分化,但最终伴随细胞死亡。这揭示了基因剂量、细胞周期与分化过程之间的精细耦合关系。
多基因互作的剂量敏感性
在组合扰动实验中,研究者发现不同转录因子的相互作用不仅取决于基因组合本身,还强烈依赖于基因剂量。同一对转录因子组合在不同剂量下可表现为可逆转的协同或拮抗作用,且这种效应具有基因特异性,进一步凸显了基因网络调控的复杂性。
综上,该研究表明,基因剂量不仅决定单个基因的功能,还塑造了基因与细胞过程的互作格局,以及多基因间的协同与竞争关系。scTF-seq为系统性地解析这些剂量依赖效应提供了新方法,产生的基因定量扰动数据也为精准细胞工程和虚拟细胞模型构建提供了关键支撑。
该工作由中国科学院深圳先进技术研究院合成生物学研究所和瑞士洛桑联邦理工学院(EPFL)合作完成,陈万泽研究员和Bart Deplancke教授为共同通讯作者,刘王杰(博士生)、Wouter Saelens(博士后)和Pernille Rainer(博士生)为共同第一作者。该工作获得了重点研发计划、国家自然科学基金委、深圳市医学研究专项和深圳合成生物学创新研究院等项目的支持。
陈万泽博士现为中国科学院深圳先进技术研究院合成生物学研究所研究员,博士生导师,主要研究方向是通过新技术的开发,理解细胞命运决定机制并进行改造和干预,得到国家自然科学基金优秀青年项目,国家重点研发计划课题等重要项目的支持,相关成果以通讯和第一作者身份在Nature,Nature Genetics,Nature Cell Biology等期刊发表,被Nature Biotechnology,Nature Methods,Nature Immunology等多个杂志专文评述和高亮报道。欢迎感兴趣的博士后、博士生和研究助理加入!

文章上线截图,原文链接:https://www.nature.com/articles/s41588-025-02343-7
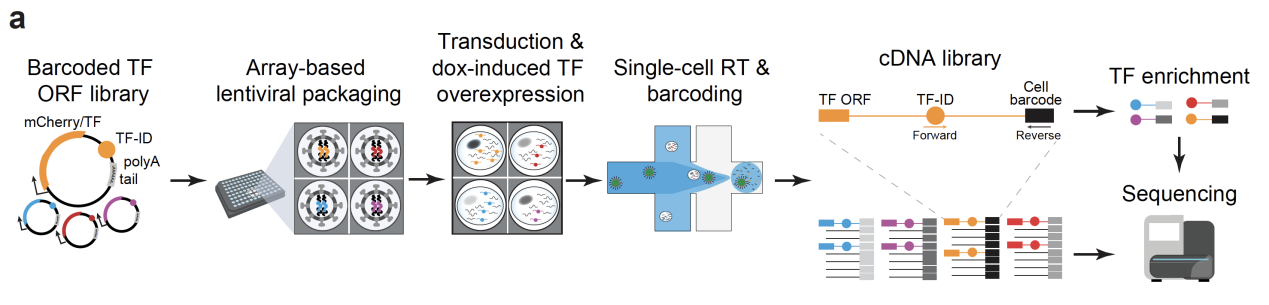
图1:scTF-seq的原理图示
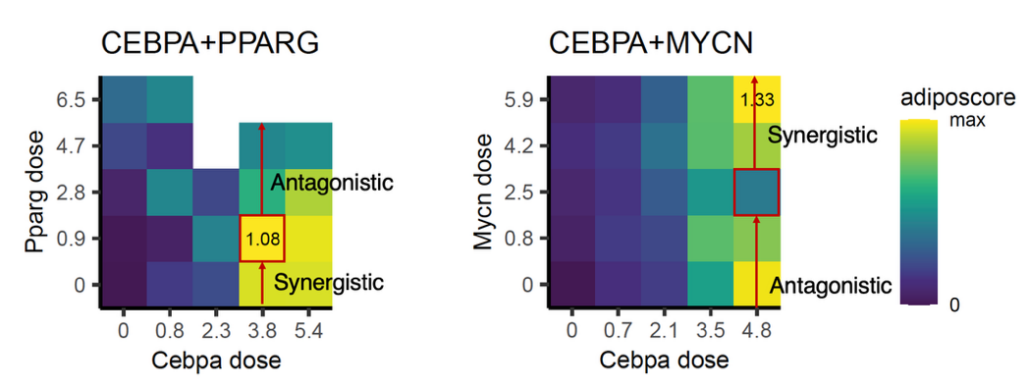
图2: 两个转录因子之间协同-拮抗效应的剂量可逆性
附件下载:


