随着年龄增长,男性性腺逐渐进入衰老状态,慢性低度炎症开始侵蚀睾丸这一免疫特权器官抗炎微环境的稳态。与此同时,许多男性在中年阶段出现“发福”现象——这并非简单的生活方式问题。最新研究显示,中年期脂肪前体细胞增殖与分化程序发生改变,推动内脏脂肪异常沉积,成为中年体重增加的直接原因。值得注意的是,多项研究发现,男性性腺功能衰退的程度与肥胖水平呈显著正相关。这一现象提示脂肪组织可能并非“旁观者”,而是加速性腺衰老的重要参与者。中年期脂肪沉积如何通过代谢与免疫信号影响睾丸稳态,进而推动性腺衰老,正成为亟待回答的关键科学问题。
1月15日,中国科学院深圳先进技术研究院医药所代谢生殖中心张键团队在 Advanced Science杂志发表最新研究 "Targeting the CMKLR1-Mediated Signaling Rebalances Immunometabolism State in Middle-Age Testicular Macrophages"。研究团队整合单细胞转录组测序、人–鼠同源性数据库挖掘、以及基于受体拮抗肽和生活方式干预的多种动物模型,系统解析了中年期肥胖相关代谢信号与男性性腺衰老之间的内在联系。研究发现,脂肪因子Chemerin可通过其受体CMKLR1调控睾丸组织驻留巨噬细胞的免疫代谢命运。在中年阶段,CMKLR1信号异常激活,驱动睾丸巨噬细胞发生代谢与功能重编程,促炎反应增强,从而干扰精子发生。进一步研究表明,靶向抑制CMKLR1或采用高强度间歇运动干预,均可有效重塑睾丸免疫代谢稳态,为延缓男性生殖衰老提供新的干预思路。
研究人员首先在中年期雄性小鼠模型(33–57周龄,对应人类约33.3–46.8岁)中观察到显著的年龄相关内脏脂肪堆积。基于睾丸单细胞RNA测序分析,研究发现,与33周龄对照组相比,57周龄中年小鼠中CMKLR1⁺睾丸巨噬细胞的趋化因子基因表达发生显著改变,并伴随M2标记物减弱及促炎因子白介素-1β(IL-1β)上调。进一步亚群分析显示,表达 CMKLR1 的 CD206LoMHCIIHi睾丸巨噬细胞在中年阶段出现糖酵解相关基因显著增强,提示其发生促炎型的免疫代谢重编程。值得注意的是,这一变化在人与小鼠之间具有进化保守性。在高BMI的老年男性睾丸中,同样检测到 CMKLR1⁺CD206LoMHCIIHi巨噬细胞的促炎代谢重编程特征,提示肥胖相关代谢信号可能共同驱动人和小鼠的性腺免疫衰老。
为明确CMKLR1在这一过程中的因果作用,研究者进一步分析Cmklr1⁻/⁻成年小鼠的睾丸巨噬细胞。结果显示,其睾丸巨噬细胞发生了向抗炎和M2 极化方向的代谢重编程,并伴随脂质分解相关基因表达上调,表明CMKLR1是调控睾丸巨噬细胞促炎命运的关键受体。在干预层面,研究发现CMKLR1拮抗肽P12C5不仅能够抑制中年期内脏脂肪扩张、改善糖耐量,还可显著延缓性腺衰老。单细胞测序结果进一步证实,P12C5 处理后,睾丸CMKLR1⁺CD206LoMHCIIHi巨噬细胞呈现脂质分解相关基因表达增强的趋势。此外,研究团队还评估了非药物干预策略。通过比较中等强度持续运动(MICT)和高强度间歇运动(HIIT),作者发现长期HIIT能显著上调该巨噬细胞亚群氧化呼吸链相关基因,并促进M2极化标记物CD206的恢复性上调,从而有助于维持睾丸抗炎免疫微环境。
该研究系统揭示了中年期“脂肪组织–CMKLR1–睾丸巨噬细胞” 轴在性腺免疫衰老中的关键作用,为通过靶向代谢–免疫通路或生活方式干预延缓男性生殖衰老提供了重要理论依据和潜在实践方案。
中国科学院深圳先进技术研究院医药所代谢生殖中心张键研究员、杨雅莉高级工程师和暨南大学医学院公共卫生与预防医学系唐佳教授为该论文通讯作者。张键团队的博士研究生朱震东为论文第一作者(唯一)。该研究获得国家重点研发计划、国家自然科学基金、广东省自然科学基金、深圳市医学研究专项资金、深圳市科技创新局、深圳市代谢健康重点实验室、深圳市代谢与生殖靶向投递技术概念验证中心、深圳中欧创新医药与健康研究中心等支持。
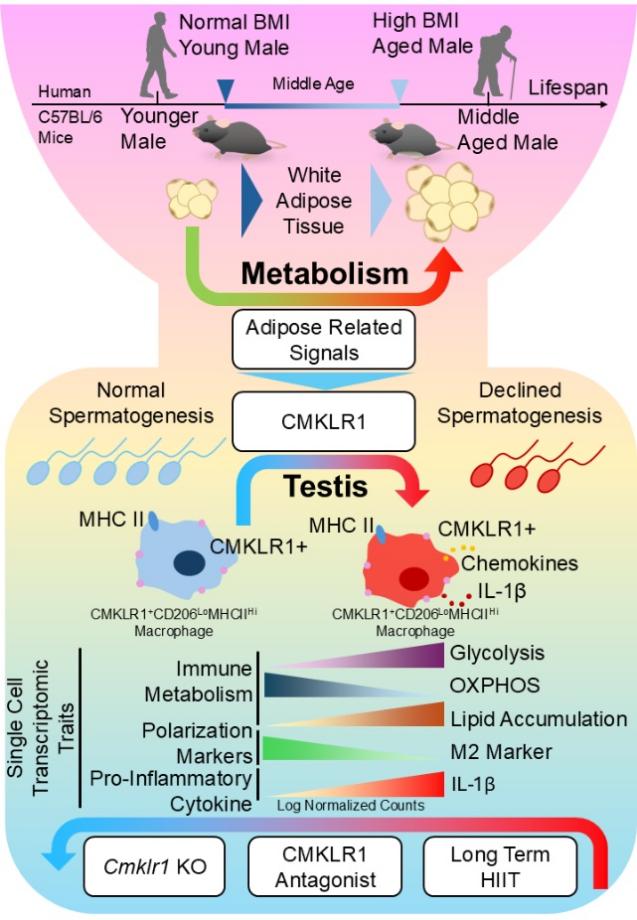
中年衰老过程中脂肪组织信号经 CMKLR1 调控睾丸巨噬细胞代谢-免疫状态及其干预机制示意图
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202515166
附件下载:


